化学漫谈005
本篇 post 把前段时间参加土库曼斯坦化学竞赛的题目做一个解答和分析。
题解
首先来看原题,该题为全卷的第五道题(共六道),标题为 Daphniphyllum alkaloids。
图片版题目
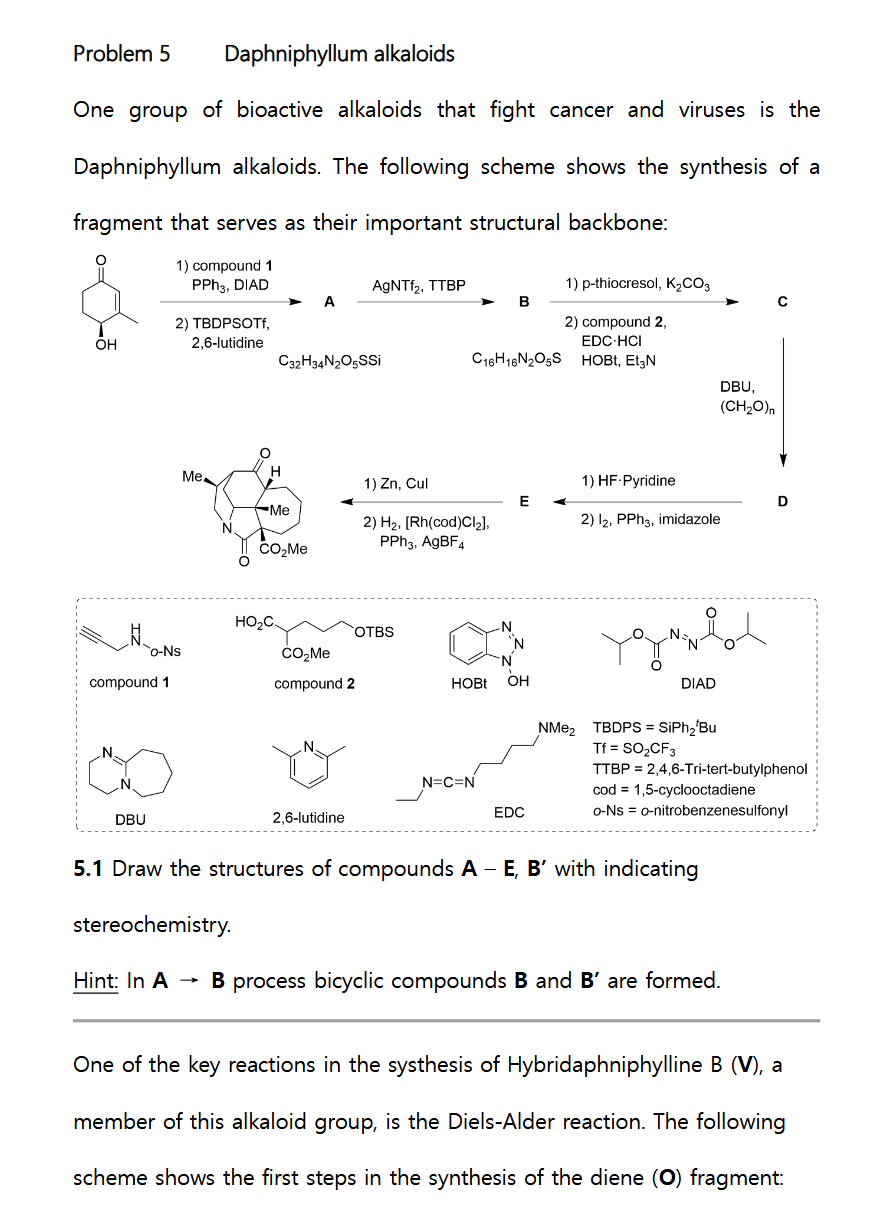


首先看 5.1,要求写出 A - E 的结构。第一步反应条件非常眼熟,PPh3 加 DIAD 的组合,很容易就能想到 Mitsunobu 反应,反应中使用的 DIAD 和最常见的 DEAD 试剂用途相当,不过更稳定,且毒性更低[1],注意 Mitsunobu 反应经典的构型翻转,然后则是烯醇硅醚的形成,得到化合物 A。
从 A 到 B 不太容易立刻想到,不过我们可以参考给出的提示,这一步反应生成了双环化合物 B 和 B’ ,说明发生了环化反应,根据最终产物结构,可以排除掉 D-A 反应的可能。再结合分子式提示,发现硅基在这一步中也脱去了,因此推出这一步环化应当是端基炔的环化,那么生成的异构体 B’ 就是缺少环外甲基的副产物。实际上这一步反应为 Conia-Ene 反应,用 Au 做催化剂的例子也非常常见。
第三步使用硫化物脱去 Nosyl group 保护[2],得到二级胺,然后和 compound 2 反应形成酰胺 C,根据最终产物也能够分析出来。
生成 D 的这一步条件比较明显,多聚甲醛可以在底物上一个碳,对照 C 和最终产物的结构发现,右侧7元环仍然少一个碳,所以就是这一步了。当然不饱和酮没办法直接在 α 位直接上,所以要先在 DBU 作用下把下面五元环酰胺构建起来。
从 D 到 E 也比较明显,首先脱保护,然后利用 Appel 反应上碘为下一步关环做准备。
最后一步则是关环同时选择性还原环外双键得到立体选择性甲基,完成全部的合成。答案见下图。
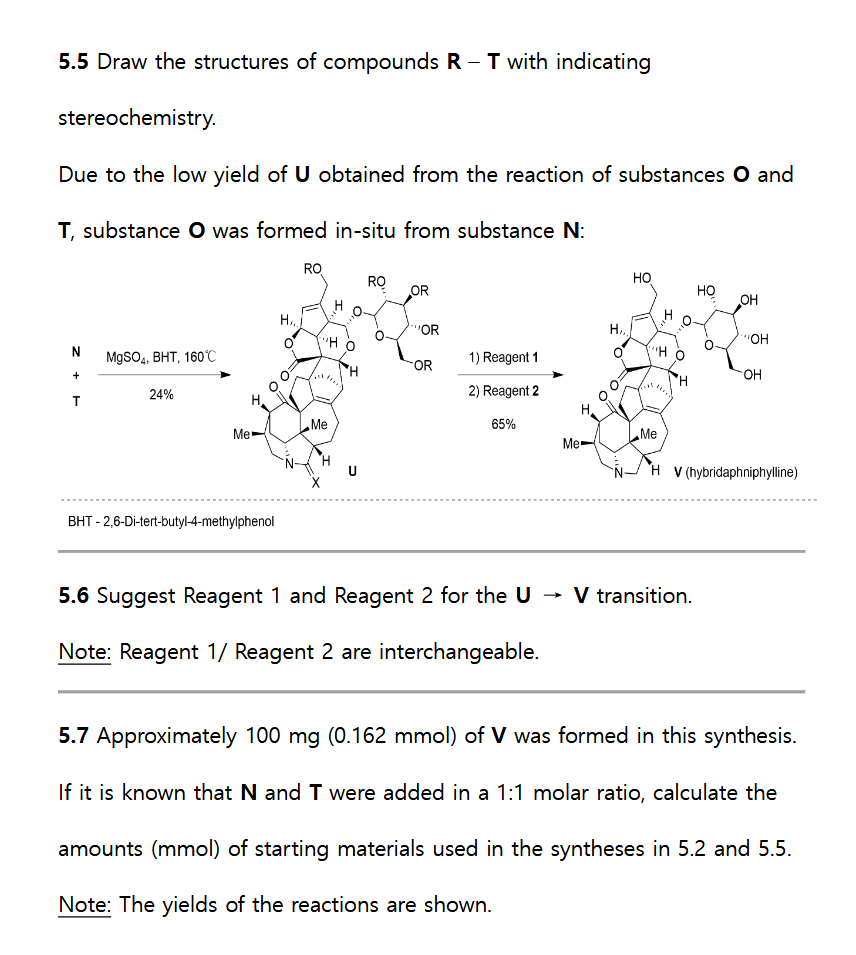
接着看 5.2,用 5.1 的产物继续合成,第一步是 β-羰基酯的脱羧(Krapcho decarboxylation),氯化锂的作用是提供卤素进攻酯的烷基,反应经历一个碳负离子中间体,注意产物的立体化学保持不变。
接下来 PhSeCl + mCPBA,可以想到是硒氧化物的消除,得到双键,显然酮的 α-H 酸性更强,因此生成 α,β-不饱和酮 G。
后面的两步反应条件和提示明显说明是 Claisen 重排,先形成烯醇醚 H,然后加热条件下重排到 α 位,得到化合物 I。而根据提示,化合物 I’ 比 I 少一个季碳中心,说明重排排到了 γ 位。重排后烯丙基倾向处在位阻更小的环上方。
从 I 到 J 包含三步反应,首先是硼氢化氧化,两个 Cy group 取代的硼氢化物说明反应在位阻更小的烯烃,得到端基醇,然后是 Swern 氧化,将上一步的醇氧化为醛。最后加入 compound 3,这一步是炔烃同系化反应(Seyferth–Gilbert homologation),最后总的结果是把烯烃变成了多一个碳的炔烃 J。
下一步使用了 Lawesson’s reagent,看结构其实可以大致推断出其作用类似 Wittig 试剂,实际上也的确如此,Lawesson’s 试剂会优先和富电子的羰基反应转化为硫代羰基[3],因此这一步反应给出硫代酰胺 K。
从 K 到 L 有提示,这是一个 Pauson-Khand 反应,它是一个 [2+2+1] 的环加成,反应条件中的 Co2(CO)8 是非常经典的催化剂,同时还提供一分子的 CO 参与反应。在这一步通过一步环加成反应构建起两个五元环。
最后一步也有提示,这是一个在碱性条件下的异构化反应,反应的驱动力是形成了更稳定的异构体,观察 L 的结构,会发现其实反应位点已经所剩无几,因此也只能是 α, β-不饱和酮双键的位移了,形成更多取代的双键。
答案见下图。
前面都是有机合成,5.3 题换了换口味,要求根据红外数据,18电子规则(EAN)绘制 Co2(CO)8 的结构。根据18电子规则不难算出该化合物中存在一条 Co-Co 金属键。但是注意 IR 数据中明显有两个峰位移偏小,因此推测有两个羰基实际上作为桥连配体存在。答案见下图。

( 在溶液中,Co2(CO)8 存在无羰基桥连的结构,即每个 Co 原子连接四个配体,同时存在一根 Co-Co 金属键,两种结构存在平衡。无桥连配体的结构毫无疑问满足 EAN,但是有桥连配体的结构在数电子上仍存在一定争议,一些研究指出该化合物(以及类似的 Fe2(CO)9 等化合物)中并不存在直接的 M-M 金属键[4],其结构可表示如下:
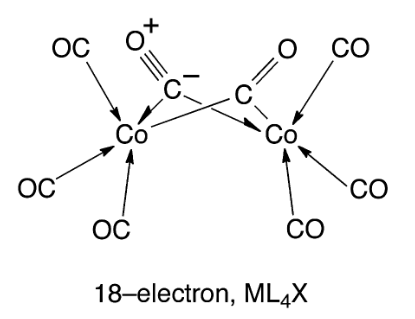
更进一步的讨论暂且不在这篇文章中展开了。 )
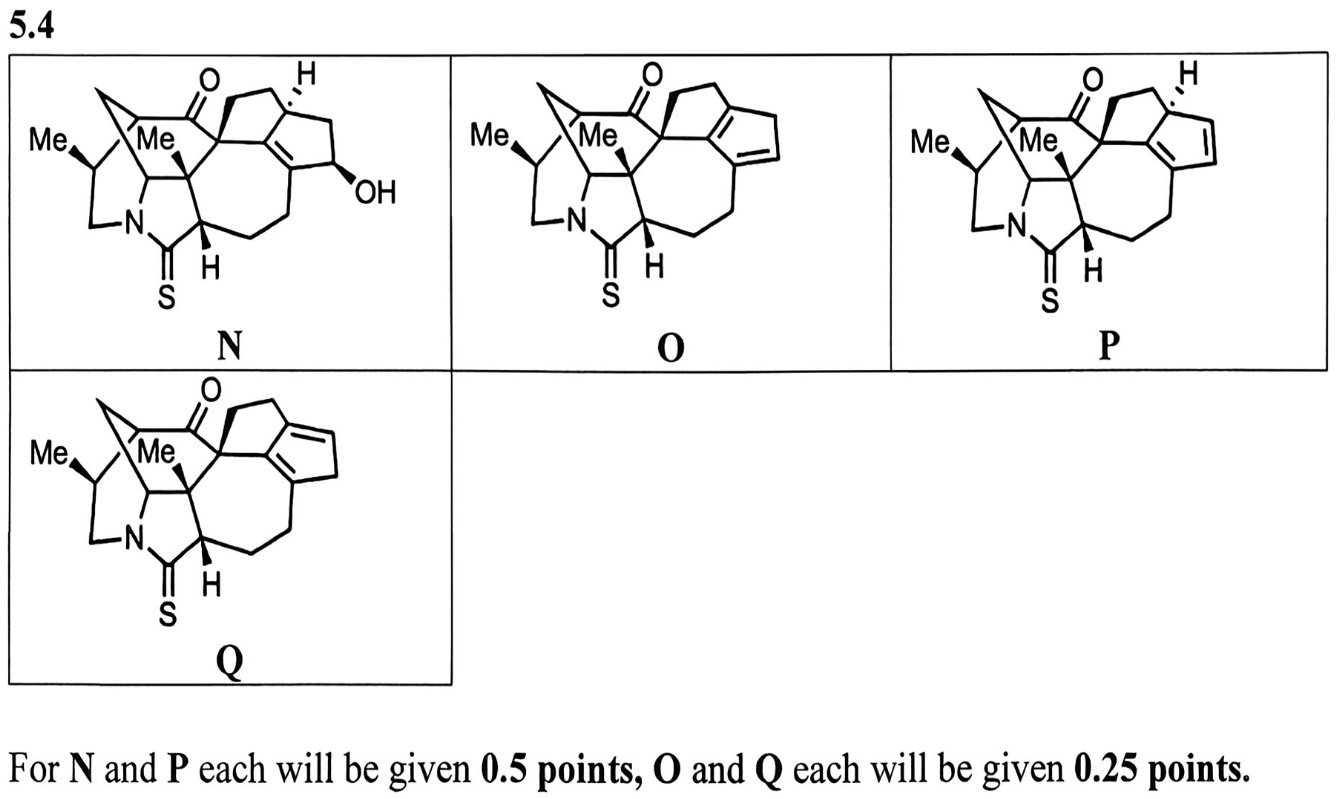
5.4 题继续开始有机合成,使用前面合成的化合物 M 作为反应物,首先使用 Luche 还原选择性还原 α, β-不饱和酮的羰基。提示说明新生成的手性中心具有 R-configuration,据此可以检查其立体构型,不过说实话,前面几步反应的立体构型并不显然,不太好判断的。
下一步的条件则是把 N 中的羟基转化为 OMs,接着发生消除反应。题干中提到 O:P = 1:16,且化合物 P 有7个手性中心,一部分 P 还会慢慢转化为 O,综合这些信息,我们就能得到化合物 O 对应 E’ 消除产物,化合物 P 对应 E2 消除产物,O 为热力学产物,P 为动力学产物。
后面又把 O 和 P 的混合物加热,发现混合物转化为 O:Q = 2.6:1,推测可能是通过 [1,5]-H 迁移之类的步骤实现双键的位移,且 Q 比 P 在热力学上要更加稳定,因此 Q 应当是尽可能多取代的烯烃,进而确定 Q 的结构。答案见下图。
然后看 5.5 题,开始合成另一个片段,依然是写产物。生成 R 的反应包括三步,第一步为 DMAP 催化的乙酰化反应,分子中有两个羟基,考虑位阻因素,一级醇是更容易与乙酰基接触并反应的。后面的两步分别是硅基化和脱硅基,但是注意脱硅基的选择性,会选择脱除位阻更小的硅基(否则这两步就没意义了对吧 😄)。
下一步加入的 compound 4 是典型的糖基化试剂,将化合物 R 中未保护的羟基糖基化,随后用 TBAF 脱硅基保护,得到化合物 S。
下一步可能不容易看出来,Me3SnOH 在此是作为弱酸发挥作用的,目的是实现分子内的酯化。该试剂通常被用来实现复杂化合物的温和条件酯水解[5],水解后会迅速生成 γ-环内酯。接下来是乙酰化,目的是为了把糖基的羟基乙酰化,最后得到片段 T。
答案见下图。

在上述的一系列合成之后,终于可以将两个片段通过 [4+2] 反应连接到一起,然后看 5.6 题,要求写出从 U 到 V 的两步转化试剂。观察化合物 U 和 V 的结构差异,发现不同之处在于 1)糖基上羟基脱除酰基;2)最下方的硫代酰胺(从 J 到 K 那一步转化的)被还原。因此这两个试剂分别对应这两个转化,可以使用 Raney Ni 来还原硫酮,使用 Et3N, MeOH, water 来脱除乙酰基[6]。本题答案不唯一,作用相同的类似试剂均可。
5.7 题就非常简单了,计算获得 100mg (0.162 mmol) 的 V 需要多少起始反应物,这就是一个非常直接的产率计算问题,直接看答案吧。
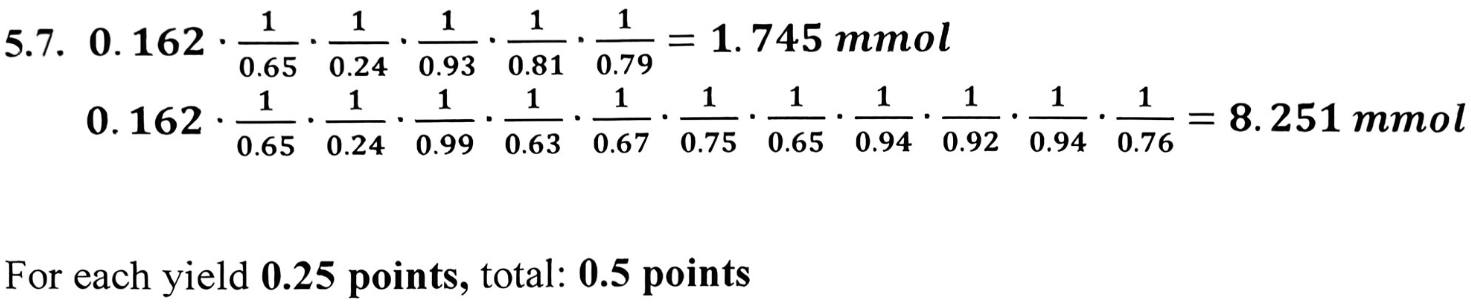
最后总结,我觉得这一整道题还是比较有难度的,尤其是考场上也没法查资料,比较考验知识面,关键步骤推不出来的话,后面的结构也很难猜。另外本题的立体化学也是一个难点,许多反应的立体选择性并不直观。
寻踪
看完了题目本身,我们来看一下这条合成路线背后的工作。Daphniphyllum alkaloid 即为交让木生物碱,交让木属(Daphniphyllum)是交让木科的唯一一属,一个听起来更耳熟的名字是虎皮楠属,该属共有30种,分布于亚洲热带和亚热带地区,其中中国有10种,且3种为中国特有,分布在长江以南地区。
Daphniphyllum 生物碱家族包含超320个分子,其具有复杂的分子结构和良好的生物活性,是合成化学家们追逐和挑战的一大目标,包括 Heathcock, Carreira, Smith, Fukuyama, Zhai, Dixon 等课题组都完成了多个优雅简洁的 Daphniphyllum alkaloids 合成设计。
本题中合成的分子为 Hybridaphniphylline B,该分子的首次合成由上海有机所的李昂课题组在2018年完成[7]。其逆合成分析思路和本题的方法一致,将复杂分子通过 Diels-Alder 反应拆分为两个片段分别合成,其中亲双烯体可以通过商用分子 (+)-genipin 容易的合成得到,而双烯体分子通过可能的 [1,5]-H 迁移和还原步骤从 4(daphnilongeranin B) 和 5(daphniyunnine C) 得到。进一步的,分子中的双环 [3.3.0] 骨架可通过已有的 Pauson-Khand + C=C bond migration 策略合成[8],再通过 Claisen 重排推出底物11,该化合物11已经在2017年同样由李昂课题组完成了全合成[9](对应题 5.1),此处按下不表。
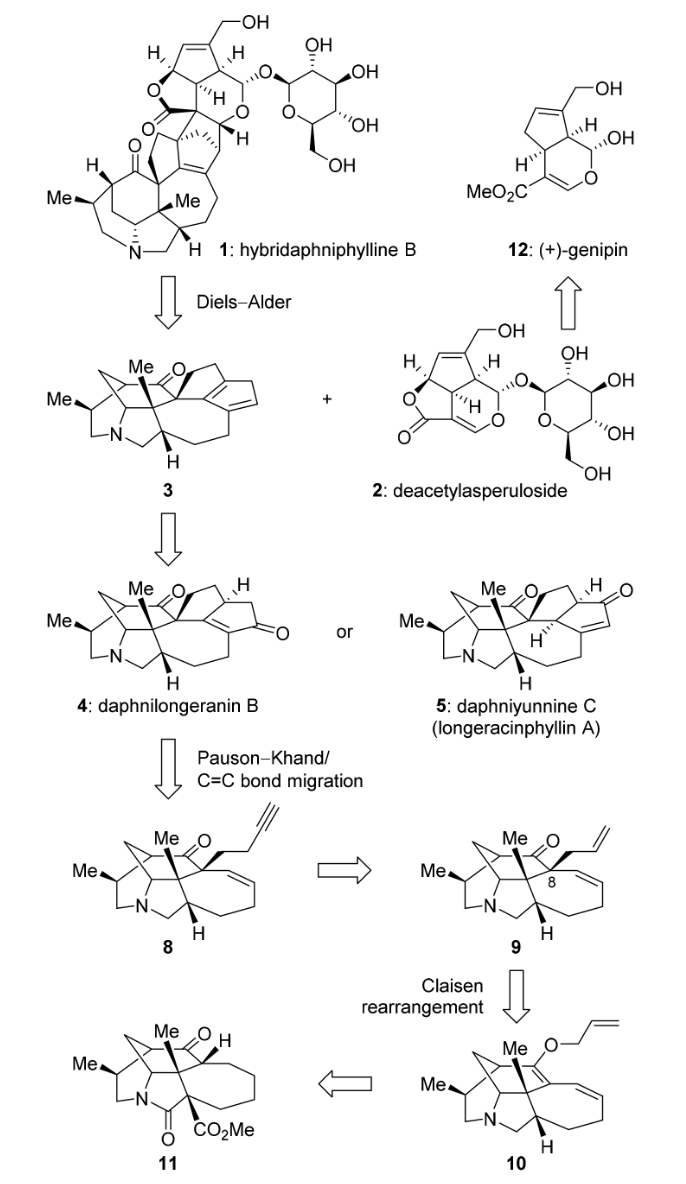
这里的合成路线和题 5.2 的步骤是一样的,所以不多赘述,我们着重看几个重点步骤。
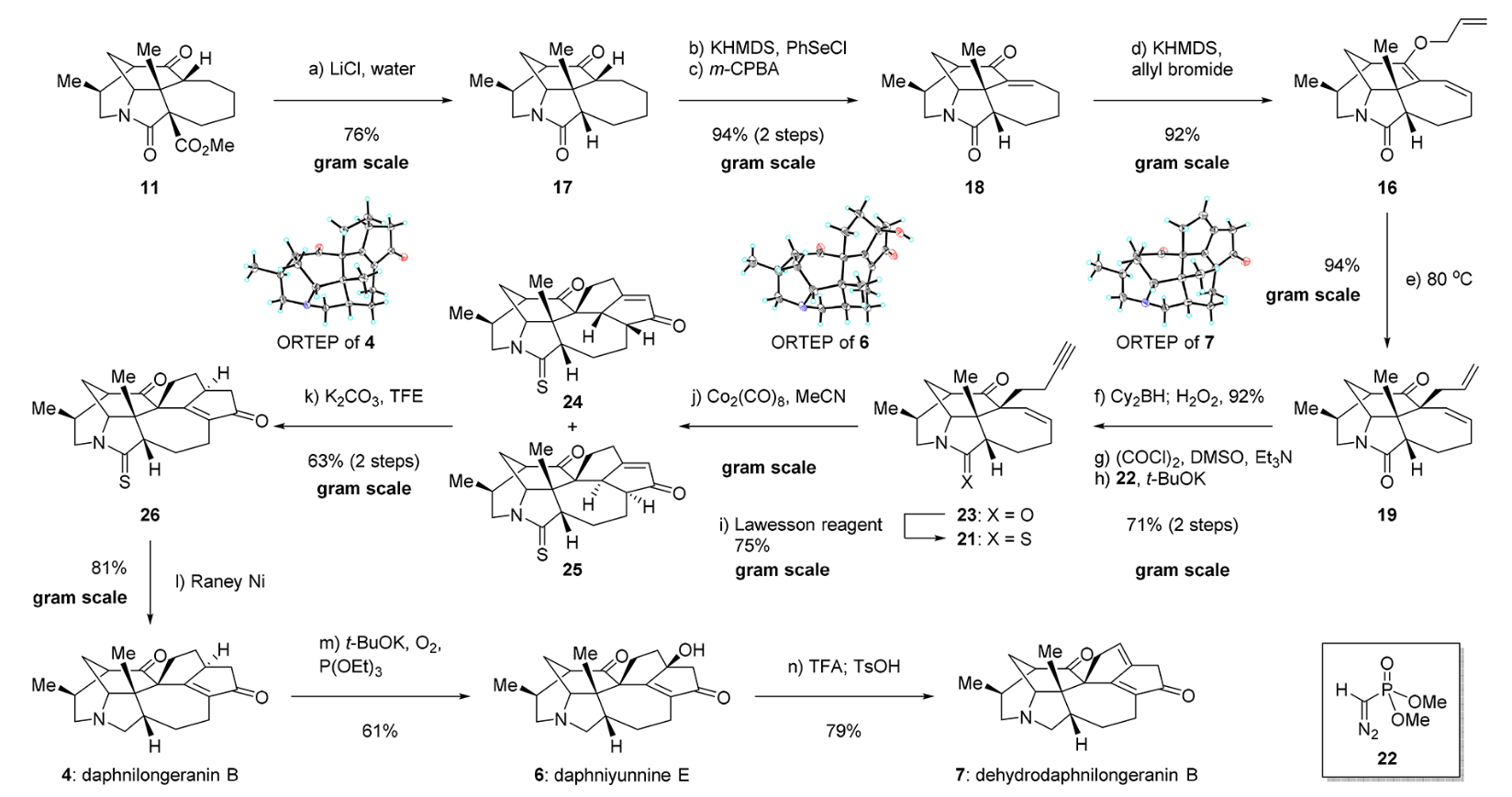
Claisen 重排一步也是作者在文章中着重讨论的一个反应,对于底物13,在加热条件下,目标重排产物14非常少(< 2%),主要产物为经历了 Claisen/Cope 连续两步重排的15。更换了条件后仍未好转(不过副产物15的立体选择性变好了)。对于脱羧后的底物16有所好转,普通加热条件下目标产物19的产率来到 48%,延长反应时间只观察到副产物增多,最后课题组选用了 aq. NaOH/MeOH, 80℃, 3d 条件[10],成功获得了94%产率的目标产物,且无副反应发生。

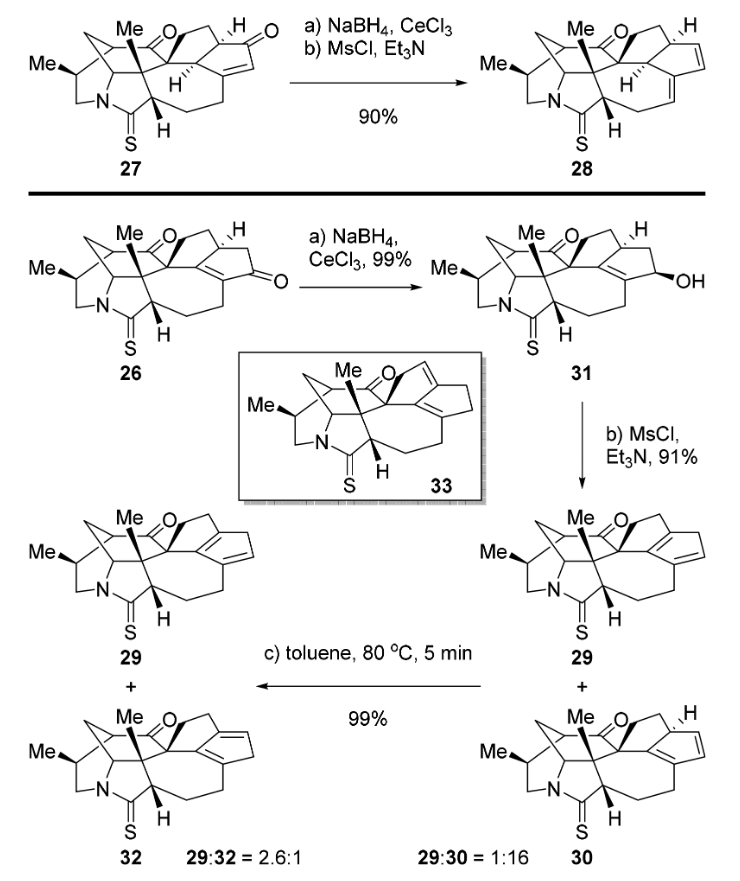
在化合物31通过消除反应制备双烯体时,直接消除会得到两种不同的异构体29和30,比例为 29:30 = 1:16,混合物加热后变为化合物 29:32 = 2.6:1,继续延长反应时间还会出现二烯33,比例略少于32。化合物33可以从混合物中分离出来,研究者发现该化合物会在 80℃, 4h 条件下继续转化为 29, 32和33的混合物,因此作者判断副产物33在加热条件下不会影响 Diels-Alder 反应的产率。
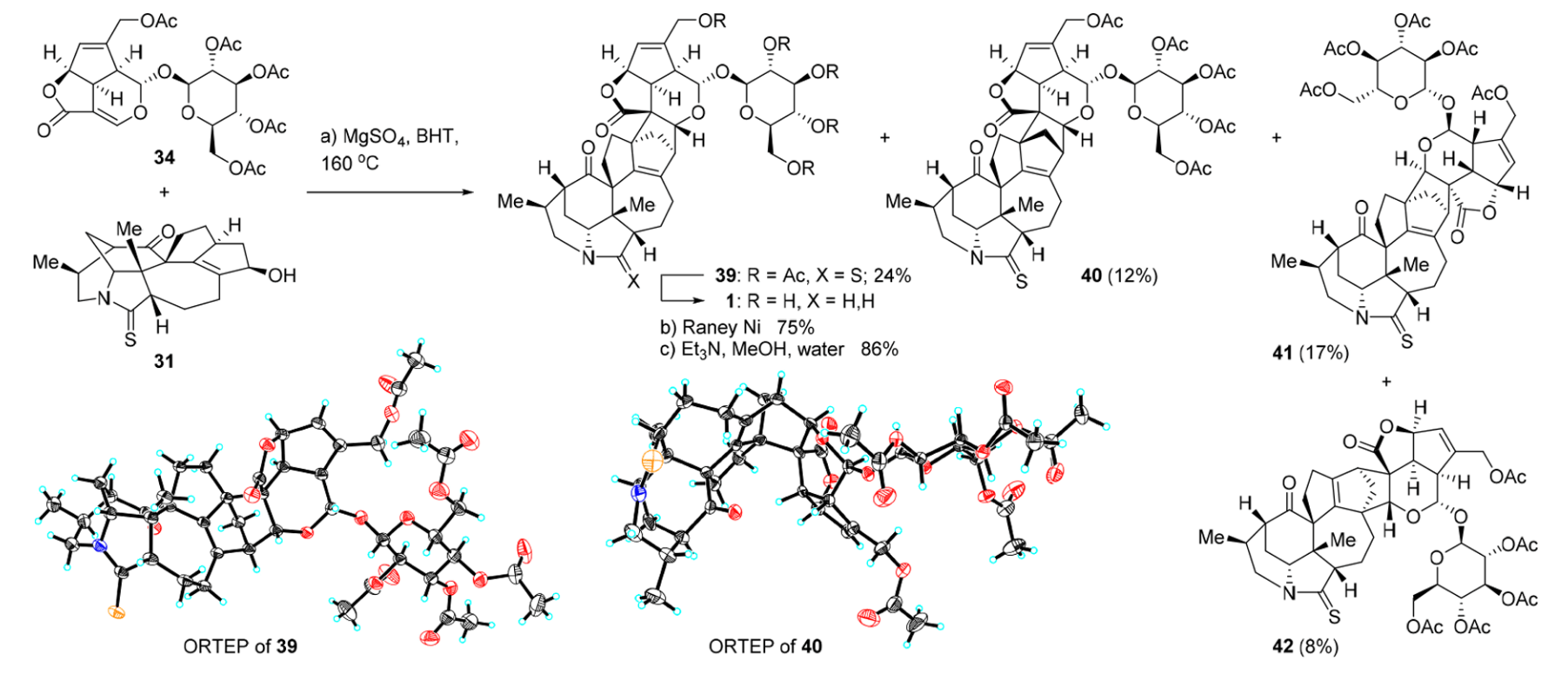
最后看一下亲双烯体的合成,从商用试剂 (+)-genipin 开始可以用已知的四步策略合成化合物35[11]。不过化合物35中需要参与反应的羟基被保护了,而不想反应的羟基却没有保护,所以不得不需要几步反应来调整保护基,一共通过四步反应总产率约 63.7%得到糖基化产物38。
值得注意的是从35到36这一步反应中发生了消旋,生成了1:1比例的差向异构体(anomers),因此在糖基化这一步中使用了 dynamic kinetic resolution 来将产物转化为对映纯的所需产物。
( 其实如果底物也具有单一立体构型,实际上也可以令产物中糖苷键立体构型均保持底物的立体构型,其机理大致是通过反式乙酸酯基邻基参与后再发生 orthoesters rearrangement 完成的[12]。
更多有关 kinetic resolution 的部分也许可以以后专门写一篇post,在此处就不展开了。 )
最后,万事俱备,只需把上文分别合成的两个片段通过 Diels-Alder 反应连接到一起即可。反应共生成四种产物,其中目标产物39约占24%。
总结
查看这些竞赛问题背后的研究工作能够发现,在现实科研中遇到的种种问题往往会更加复杂和棘手,许多反应并不会按照你所设想的那样进行,产物的立体化学/副反应/产率等等是在科研中必须要面对和解决的问题。毕竟化学是一门高度依赖实践的学科,所谓“纸上得来终觉浅,绝知此事要躬行”。
参考
- 1.Croll, E. A.; Kwon, O. Mechanism of the Mitsunobu Reaction: An Ongoing Mystery. Synthesis 2024, 56 (12), 1843–1850. ↩
- 2.Cardullo, F.; Donati, D.; Merlo, G.; Paio, A.; Salaris, M.; Taddei, M. Deprotection of o -Nitrobenzensulfonyl (Nosyl) Derivatives of Amines Mediated by a Solid-Supported Thiol. Synlett 2005, 2005 (19), 2996–2998. ↩
- 3.Ozturk, T.; Ertas, E.; Mert, O. Use of Lawesson’s Reagent in Organic Syntheses. Chem. Rev. 2007, 107 (11), 5210–5278. ↩
- 4.Green, J. C.; Green, M. L. H.; Parkin, G. The Occurrence and Representation of Three-Centre Two-Electron Bonds in Covalent Inorganic Compounds. Chem. Commun. 2012, 48 (94), 11481. ↩
- 5.Nicolaou, K. C.; Estrada, A. A.; Zak, M.; Lee, S. H.; Safina, B. S. A Mild and Selective Method for the Hydrolysis of Esters with Trimethyltin Hydroxide. Angew Chem Int Ed 2005, 44 (9), 1378–1382. ↩
- 6.Mangion, I. K.; MacMillan, D. W. C. Total Synthesis of Brasoside and Littoralisone. J. Am. Chem. Soc. 2005, 127 (11), 3696–3697. ↩
- 7.Zhang, W.; Ding, M.; Li, J.; Guo, Z.; Lu, M.; Chen, Y.; Liu, L.; Shen, Y.-H.; Li, A. Total Synthesis of Hybridaphniphylline B. J. Am. Chem. Soc. 2018, 140 (12), 4227–4231. ↩
- 8.Sisido, K.; Kurozumi, S.; Utimoto, K. Synthesis of Methyl Dl-Jasmonate. J. Org. Chem. 1969, 34 (9), 2661–2664. ↩
- 9.Li, J.; Zhang, W.; Zhang, F.; Chen, Y.; Li, A. Total Synthesis of Longeracinphyllin A. J. Am. Chem. Soc. 2017, 139 (42), 14893–14896. ↩
- 10.Grieco, P. A.; Brandes, E. B.; McCann, S.; Clark, J. D. Water as a Solvent for the Claisen Rearrangement: Practical Implications for Synthetic Organic Chemistry. J. Org. Chem. 1989, 54 (25), 5849–5851. ↩
- 11.Nakatani, K.; Shimano, K.; Hiraishi, A.; Han, Q.; Isoe, S. Synthesis of Asperuloside Aglucon Silyl Ether and Garjasmine from (+)-Genipin via Gardenoside Aglucon Bis(Silyl Ether) as a Common Intermediate. Bulletin of the Chemical Society of Japan 1993, 66 (9), 2646–2652. ↩
- 12.Yang, Z.; Lin, W.; Yu, B. Rearrangement of Sugar 1,2-Orthoesters to Glycosidic Products: A Mechanistic Implication. Carbohydrate Research 2000, 329 (4), 879–884. ↩