《Organometallic Chemistry》章末总结1
开始金属有机系列,本系列post主要参考内容是 Harvard 大学 M. Christina White 教授的金属有机化学讲义,以及 Robert H. Crabtree 教授的《The Organometallic chemistry of transition metal》(4th ed.) 教材,主要以金属有机反应为核心。
1.1 Structure of transition metal complex
金属有机反应现在已经广泛的发展和应用,这部分的例子我想应该不必赘述了,只需去期刊看看有多少金属有机方法学的文章就可以了。我们就直入主题,首先来讨论过渡金属化合物的电子结构,那么数电子就是一个非常基础但又非常重要的技能,这里我们快速介绍一下然后看几个例子。
第一步是确定金属氧化态,根据配体的电荷来计算金属的氧化态;第二步是计算金属的 d 电子数,注意这里的 d 电子也包括外层 s 轨道电子,例如 Co(0) 的价电子构型为 $3d^64s^2$,我们下文讨论时直接把它当作 8 个 d 电子;第三步根据金属的 d 电子数和配体提供电子数得到金属配合物的总电子数。
至于如何确定配体的电荷以及配体对金属提供的电子可以参考下表:
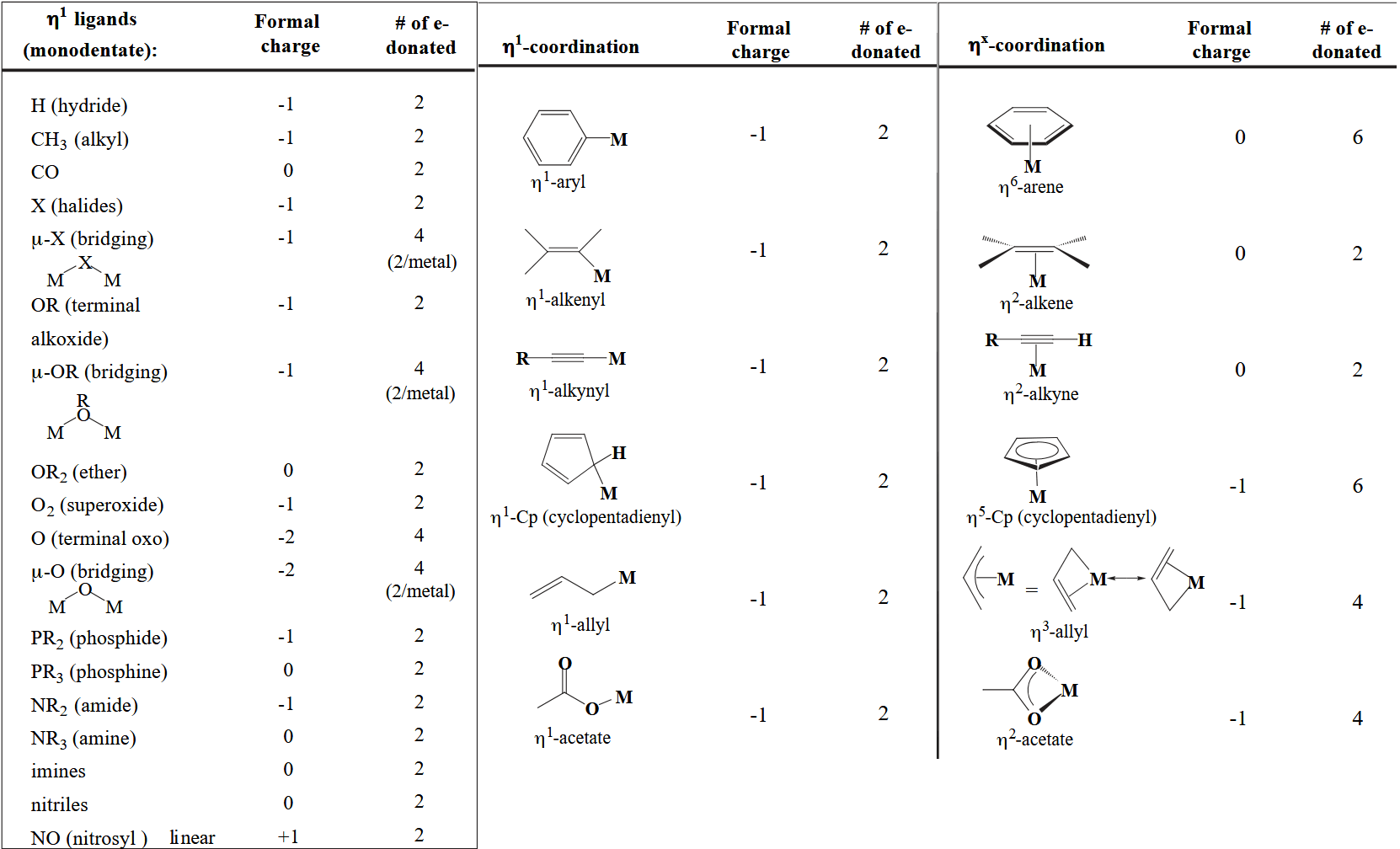
如上表所示,像卤素,烷氧基,烷基等配体形式电荷为 -1,提供两个电子;像 CO,三烷基膦等配体为中性,形式电荷为 0,提供两个电子;像茂基等不饱和配体可以提供多个电子。
接下来看三个例子。
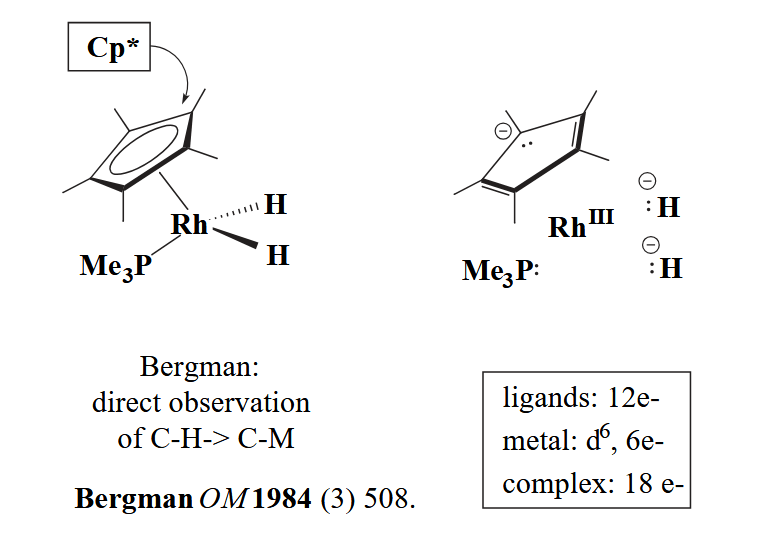
第一步,两个 H 配体和一个 Cp* 配体,具有三个形式电荷,因此中心金属氧化态为 III;第二步,Rh(III) 的 d 电子数为 9-3=6 个;第三步,2个 H 配体和一个烷基膦配体分别提供2个电子,一个 Cp* 配体提供6个电子,一共为18个电子。
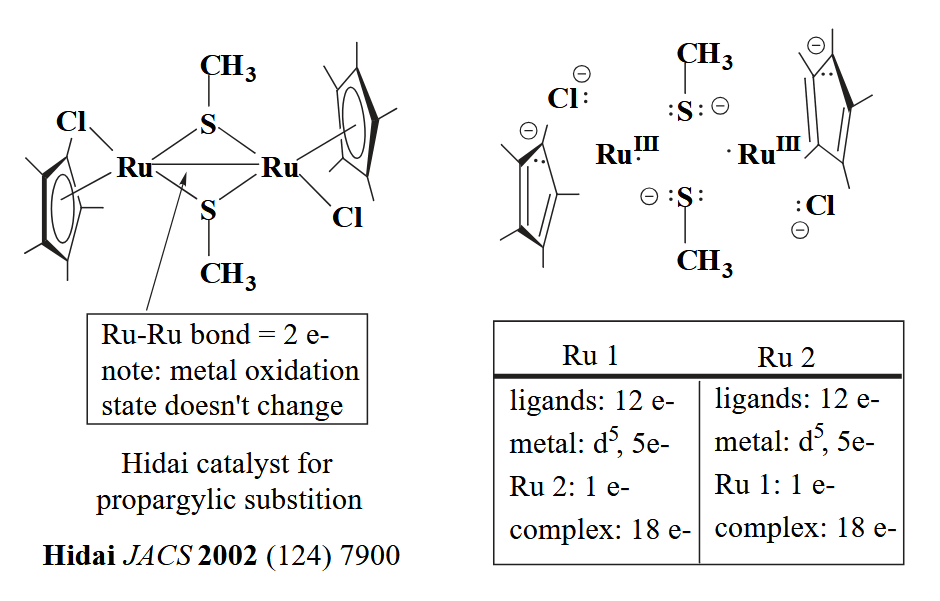
第一步,两个 Ru 的化学环境是完全相同的,因此分析一个就可以。一个 Cp* 配体带一个形式电荷,两个 -SMe 分别带一个形式电荷,但是 S 同时配有两个金属,因此每个金属只分到一半电荷(即两个硫甲基配体对一个金属总共提供一个电荷),一个氯离子提供一个电荷,金属键可以看作是两个 Ru 分别提供一个电子形成的,不提供电荷,因此 Ru 氧化态都为 III;第二步,Ru(III) 的 d 电子数为 8-3=5 个;第三步,氯和硫甲基分别提供2个电子,Cp* 配体提供6个电子,金属键的形成相当于每个金属为对方提供一个电子,因此一共也是18个电子。
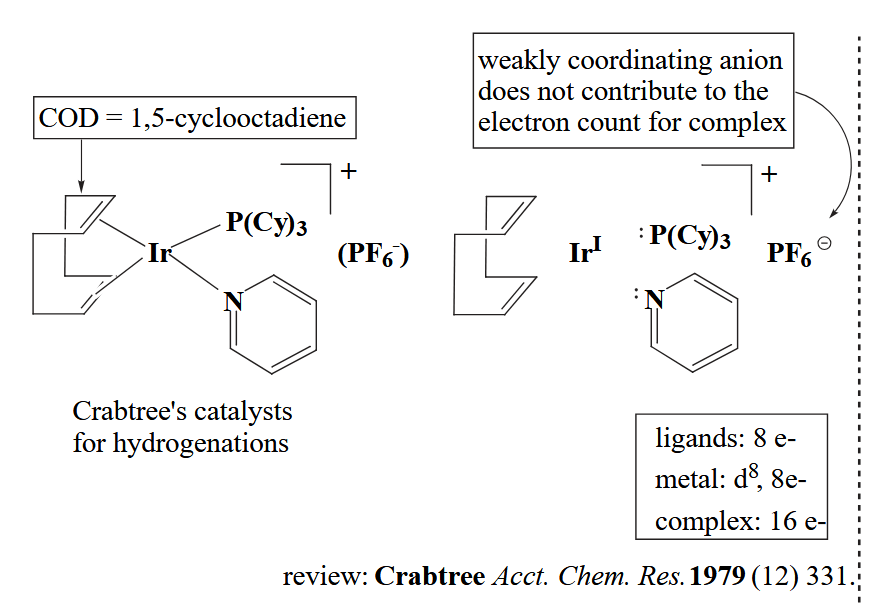
第一步,三个配体均为中性,不带形式电荷,但是注意配合物本身是一价阳离子,因此 Ir 氧化态为 I;第二步,Ir(I) 的 d 电子数为 9-1=8 个;第三步,吡啶和膦配体分别提供2个电子,COD 配体的两个烯烃一共提供四个电子,因此一共是16个电子。
从上面的例子中不难看出,许多配合物具有 18 电子的稳定构型,这被称为 18 电子规则,出现这种情况实际上并不令人意外,因为把金属的d/s/p轨道全部填满后即为18电子,这也正是稀有气体的电子构型,因此比较稳定也是很合理的。从分子轨道角度考虑,对于 $ML_6$ 型化合物,填充 18 个电子后,恰好把所有成键轨道填满,且反键轨道全空,因此具有最大键级,结构稳定。
不过并非所有配合物均为18电子构型,事实上,大量的配合物均不满足18电子构型,其电子排布从 14 - 18 个电子都是存在的,所以不要先入为主。第一周期的过渡金属羰基配合物往往满足18电子规则,如下图所示:

有些金属配合物的电子数为17,为了形成18电子构型,它们会在金属间形成 M-M 金属键,可以认为是互相为对方提供一个电子,这样双核金属配合物的两个中心金属均满足18电子规则,如上表的 $Mn_2(CO)_{10}$
下面我们讨论过渡金属配合物的几何构型及其影响因素。对于过渡金属配合物来说,常见的几种构型包括线性构型、平面三角型、平面四方型、四面体形、三角双锥型、八面体型等等,这些构型又引出配位数的概念。配位数(coordination number)即指同一个金属上所连接的配体数,不同的金属和配体都会对配位数产生影响,总的来说,低氧化态金属/大位阻配体易形成低配位数配合物;反之,高氧化态金属/小位阻配体易形成高配位数配合物。
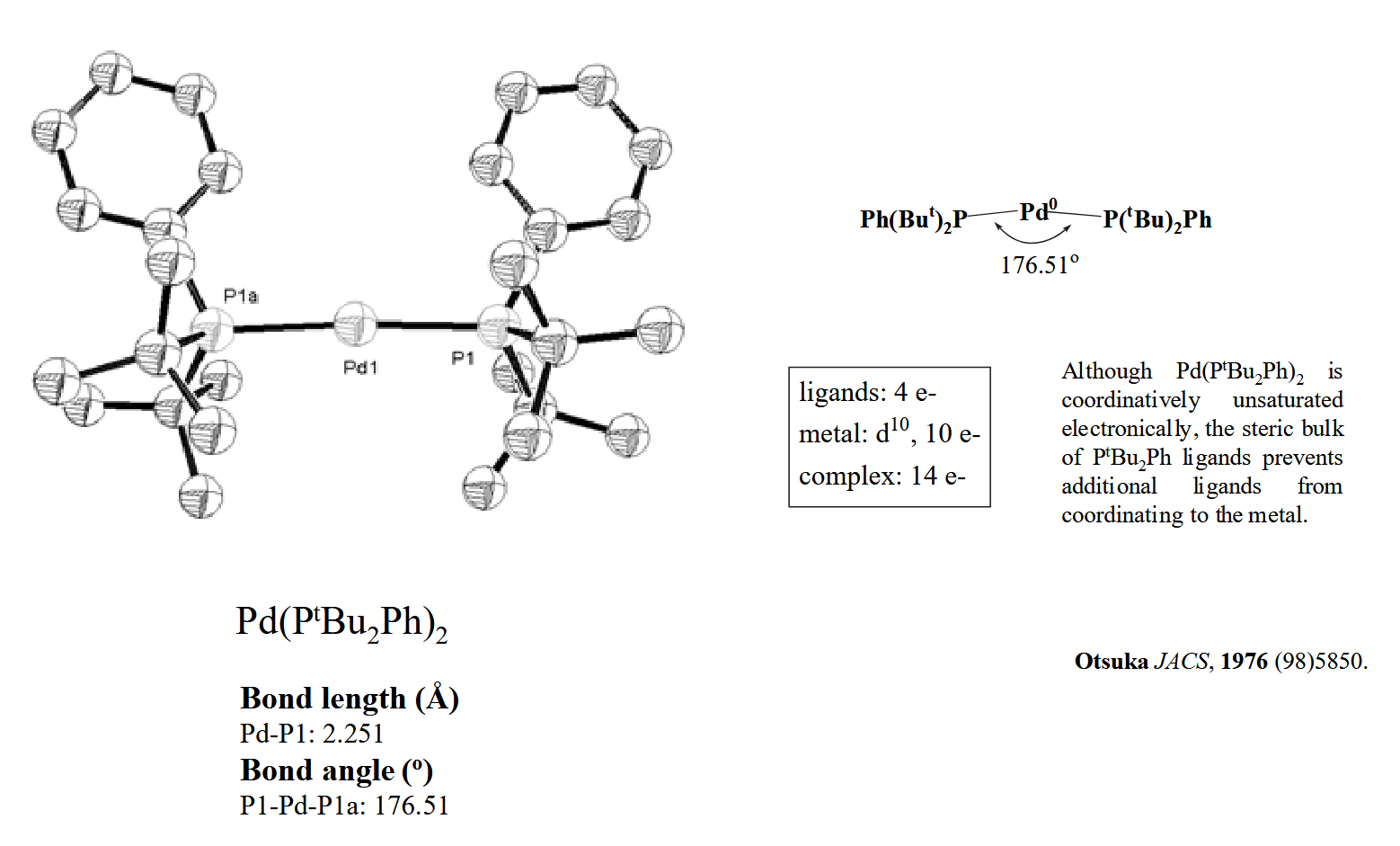
配位数的多少是电子效应(金属的富电子程度)和位阻效应(配体的位阻大小)共同平衡的结果,同样的,配合物的几何构型也是这二者相互平衡的结果。例如配合物 $Pd(P(t-Bu)_2Ph)_2$,不难算出其电子数为 14,金属 Pd 仍处于配位不饱和的状态,但是由于其配体的巨大位阻影响,因此其只有两个配体,其构型呈现为近乎线性的构型。
对于第八副族的金属来说,常见的配位数为4,其空间构型为四面体或平面四方形,二者往往处于转变的平衡。以 $MX_2L_2$ 为例,对于平面四方形来说,电子效应占主导,因为最富电子的两个配体可以处于对位;而对于四面体构型,由于配体间夹角更大(109.5°),因此位阻上更占优。
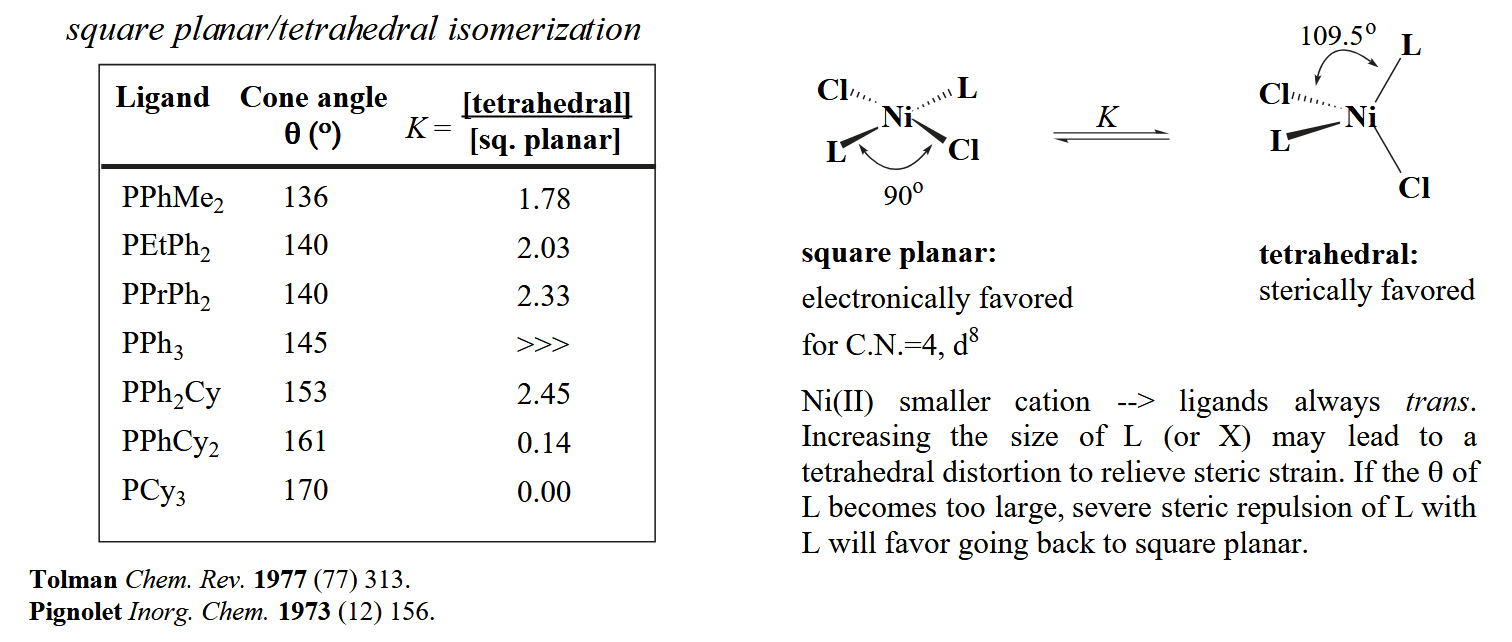
但是也注意到,如果配体位阻太大,则位阻效应此时具有决定性作用,平面四方型可以让两个最大位阻的配体处于180°对位,因此平面四方型反而在平衡中占优。
衡量位阻的大小可以用配体的 cone angle 来粗略定量考量,看下图可以直观理解 cone angle 的含义。
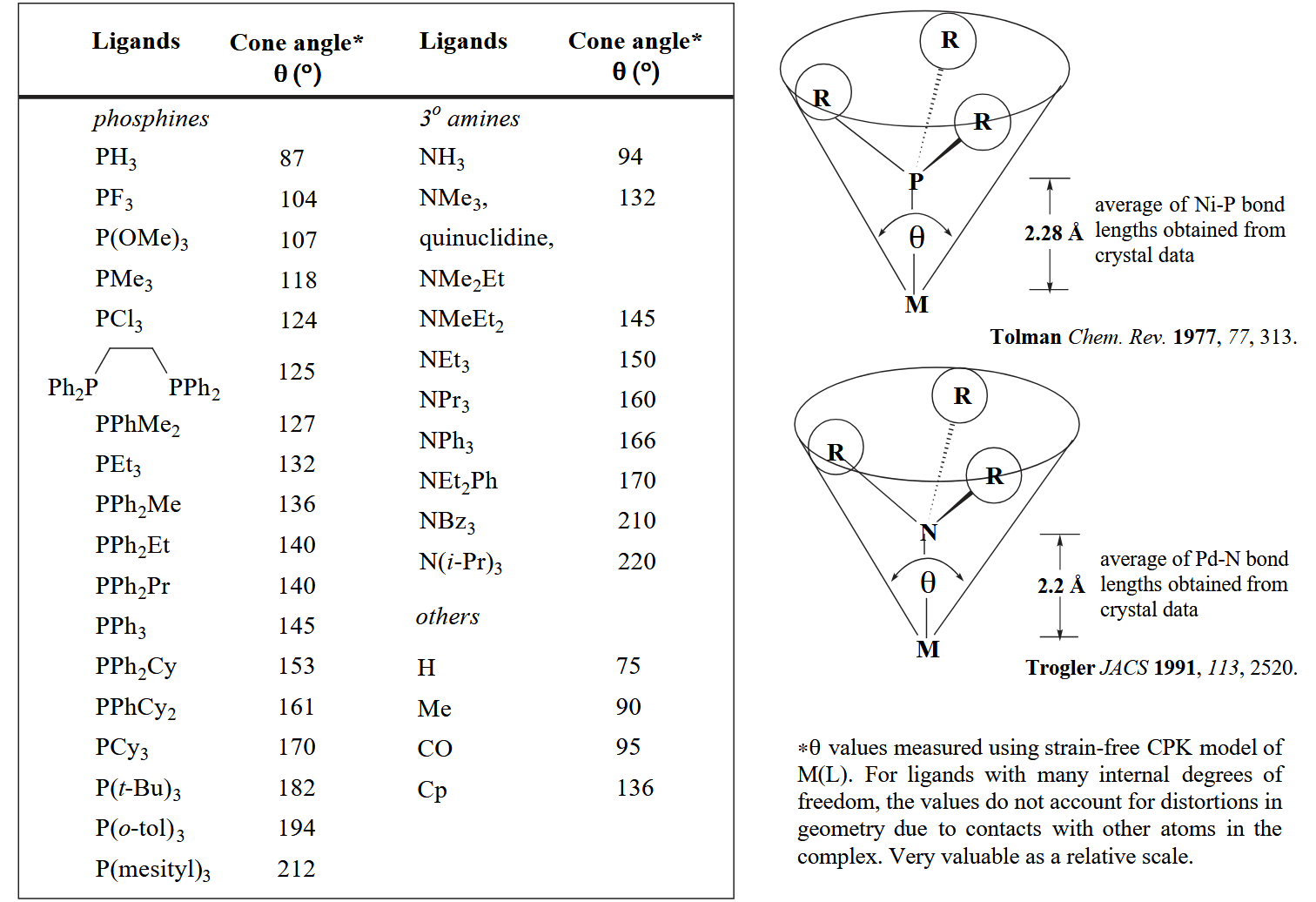
显然配体位阻越大,配位原子与金属的成键也越弱。
1.2 Bonding of transition metal complex
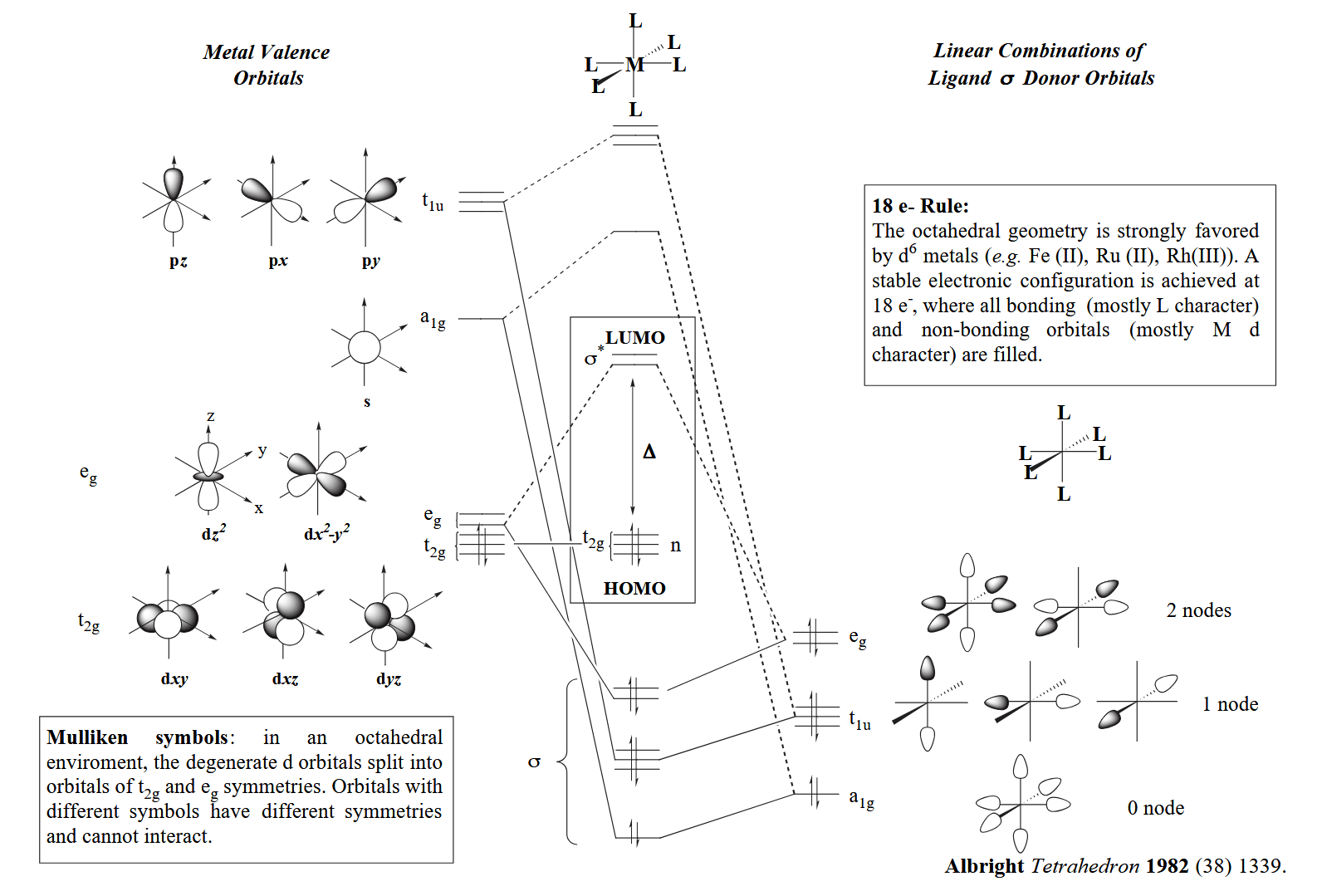
接下来讨论过渡金属配合物的成键,这部分涉及不少的分子轨道内容,理论性比较强的部分我们放到另一系列的 post 再详细讨论,本篇更多介绍反应性内容。下文所有讨论内容基于 $ML_6$ 型配合物展开,也就是在八面体配位场中讨论。
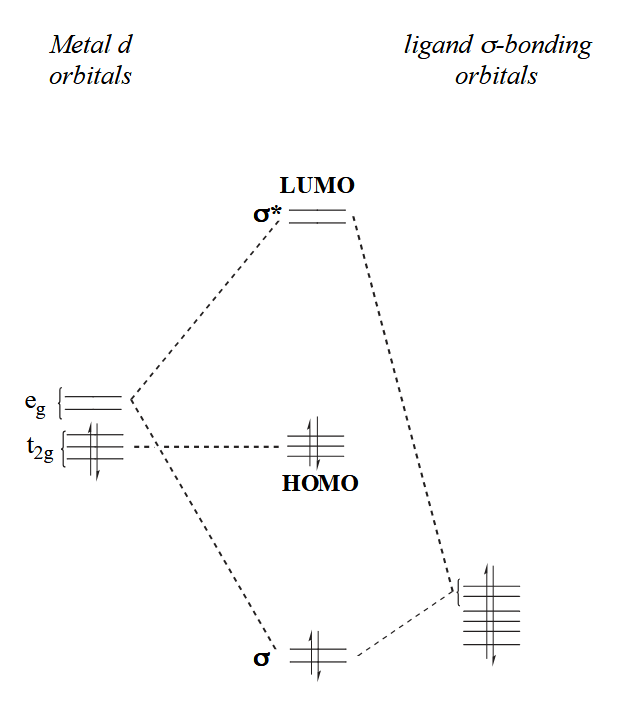
首先是 σ-bonding,成键不得不考虑轨道的对称性以确保最好的重叠,因此金属也不是所有轨道都可以参与各种类型的成键。以 σ-bonding 为例,“头碰头”类型的成键需要金属的 s/p/$e_g$ 轨道和配体的 s/p 轨道参与,这些沿键轴方向排列的轨道可以更好的“头碰头”重叠。
σ-bonding 会影响配合物的 LUMO 轨道能量,强 σ-donor 会让 LUMO 能量升高,让取代变得困难;相对的,弱 σ-donor 对 LUMO 能量升高的较少,因此取代更容易。
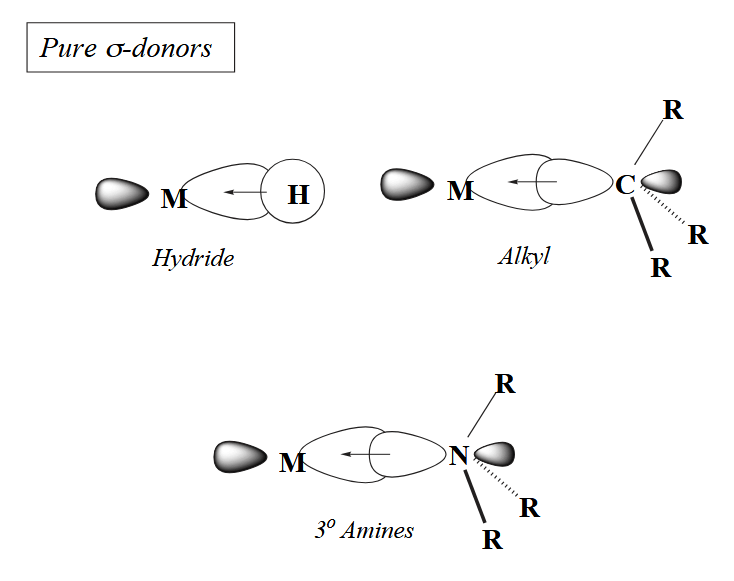
常见的 σ-bonding 配体包括氢负离子、烷基、三级胺等等。
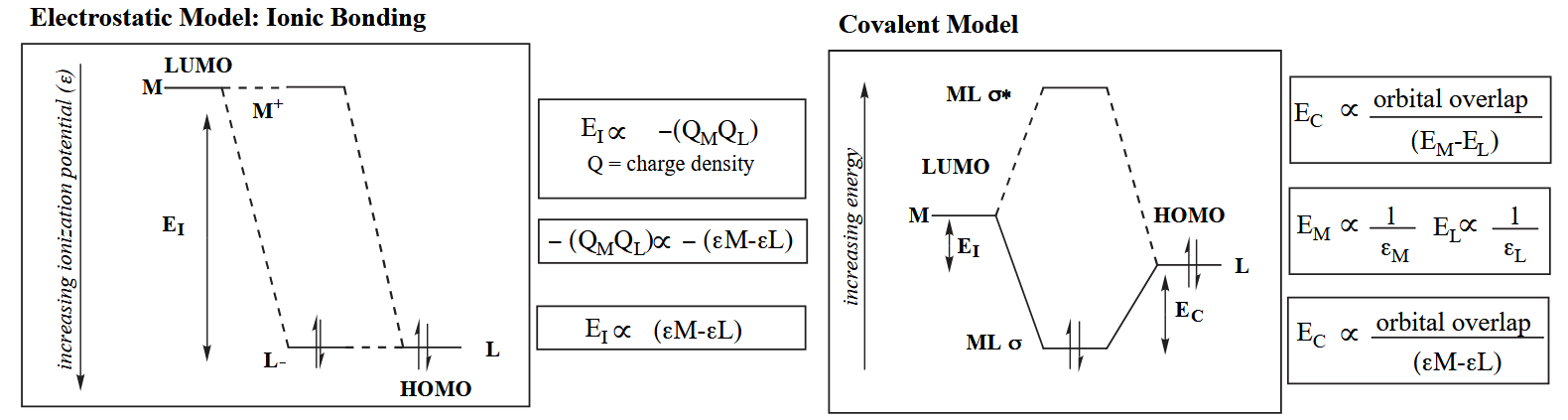
σ-bonding 的另一个要求是能量相近,配体轨道和金属轨道能量越接近,则成键性质越偏向共价键;配体轨道和金属轨道能量差越大,则成键性质越偏向离子键。
这一点可以联系到软硬酸碱理论,硬酸和硬碱相结合具有强离子键性质,其稳定性来自于 Coulombic attraction;软酸和软碱相结合具有强共价键性质,其稳定性来自于轨道重叠的共价作用对于体系能量的降低。
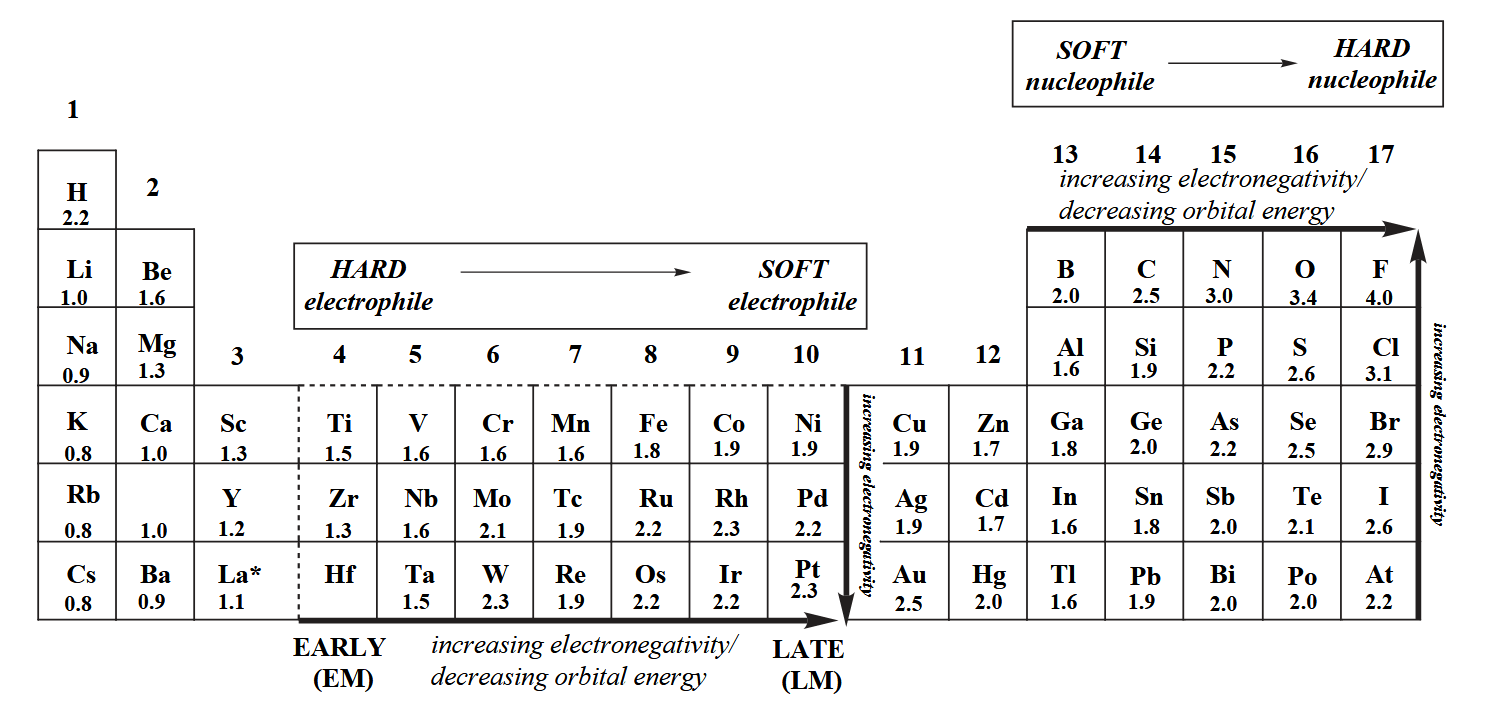
再结合元素周期表中电负性的递变规律,我们就能得到最终的结论了:late metal 属于大电负性元素,属于软酸,因此和软碱(如烷基配体)结合稳定;early metal 属于小电负性元素,属于硬酸,因此和硬碱(如烷氧基、卤素)结合稳定。这一点也能够解释为什么 early metal 往往是强亲氧(oxophilicity)元素,就是因为硬酸和硬碱结合更稳定。
位阻仍然是影响键强度的一个重要因素,通常 $1°C-M > 2°C-M >> 3°C-M$。
late metal 和烷基配体成键往往具有较强共价性质,因此能够增强轨道重叠的因素也相应的能够增强 C-M 键强度,所以 $C_{sp}-M > C_{sp^2}-M > C_{sp^3}-M$,s 轨道成分更多的碳原子具有更好的轨道重叠。
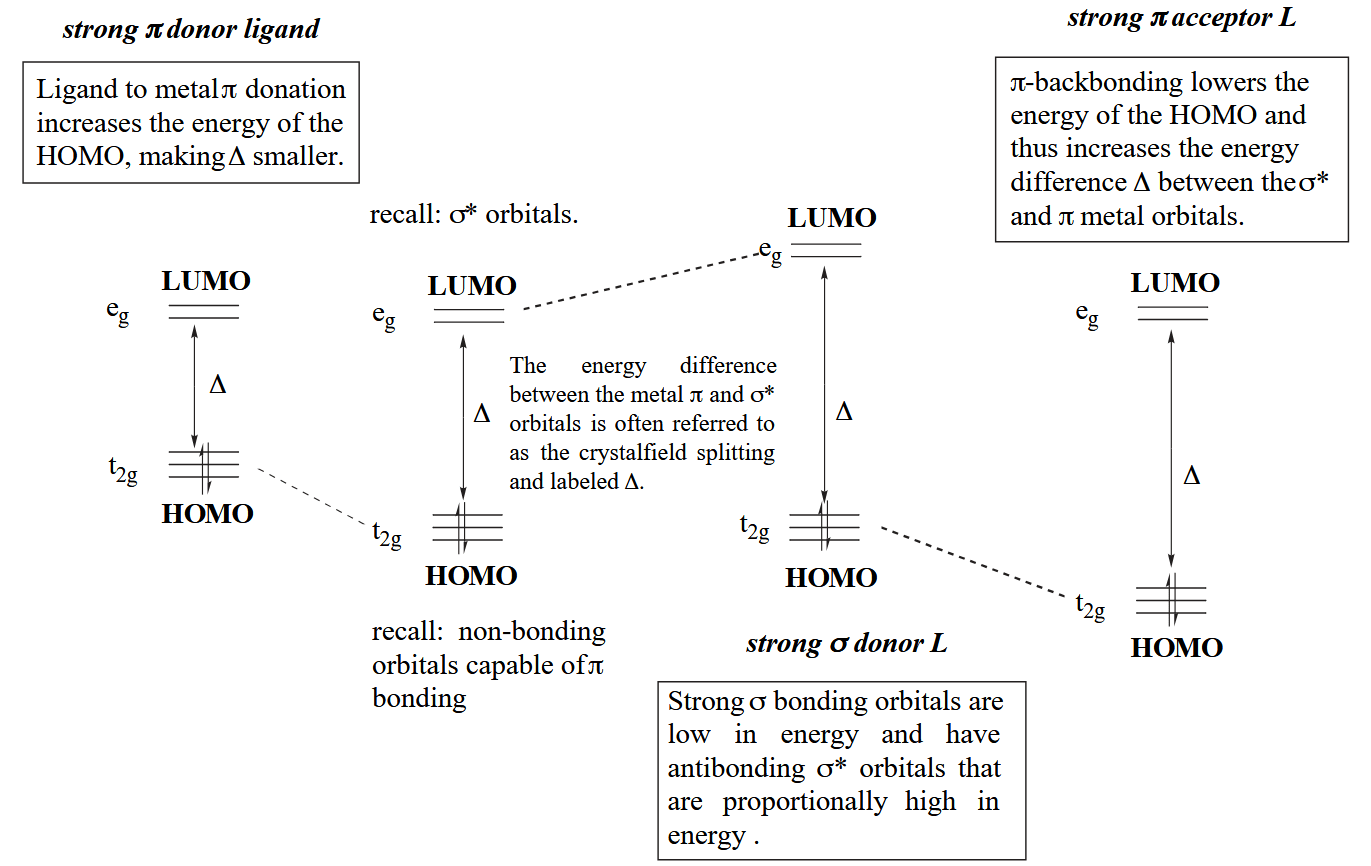
然后是 π-bonding,“肩并肩”类型的成键需要金属的 $t_{2g}$ 轨道和配体的 $t_{2g}$ 群轨道参与。π-bonding 会影响配合物的 HOMO 能量,强 π-donor 会让 HOMO 能量升高,因此金属的亲核性更强。
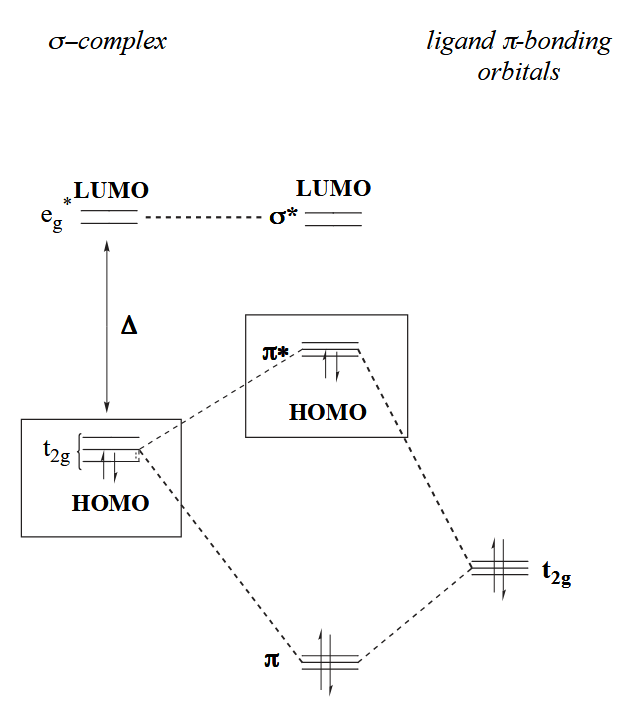
不难发现,一些配体既可以作为 σ-donor,同时又能够作为 π-donor,包括烷氧基,卤素等等,当然也有纯粹的 π-donor,如茂基等。
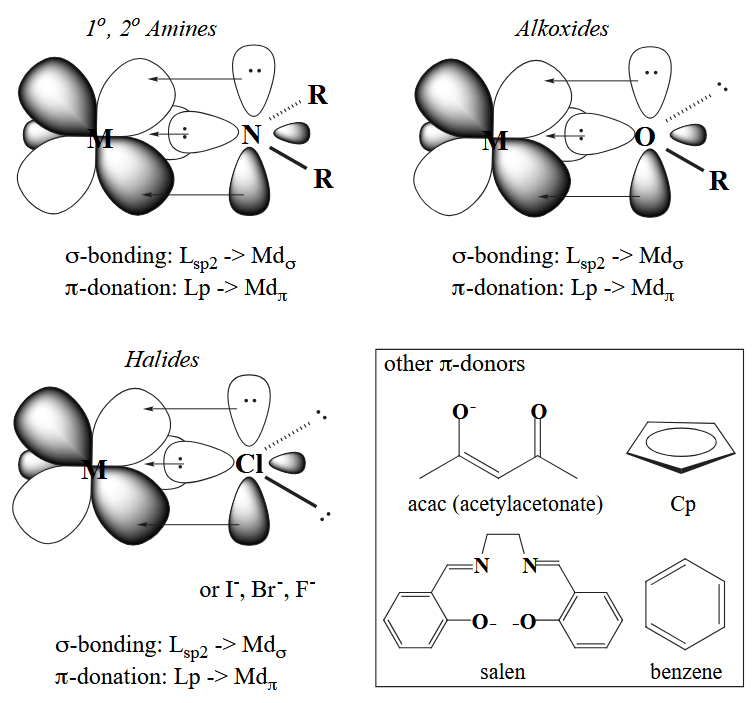
最后是 π-backbonding,顾名思义,不同于常规的配体向金属提供电子,backbonding 是金属向配体的反键轨道提供电子,需要金属的 $t_{2g}$ 轨道和配体的 $t_{2g}^*$ 群轨道参与。π-backbonding 会影响配合物的 HOMO 能量,金属的 π-backbonding 会让 HOMO 能量降低,降低金属的亲核性,电子密度的降低有利于稳定富电子的 late metal 配合物。
这种反键效应最显著的例子就是 CO,它是一个典型的 π-acid 配体。烯烃也是一个常见的 π-acid。
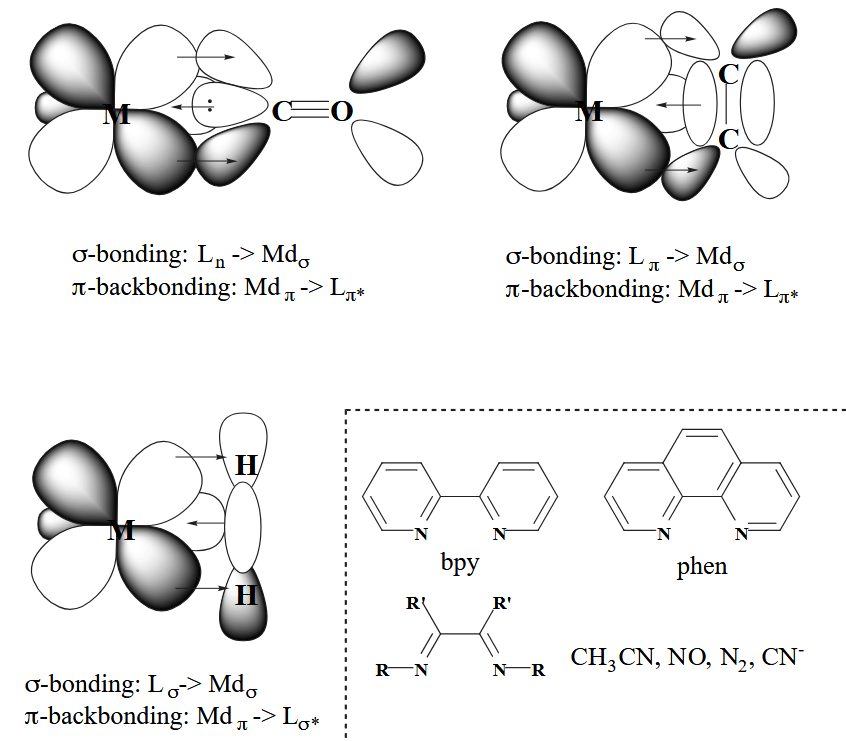
值得注意的是三烷基膦配体,之前认为这种配体和金属间也存在 M dπ → P 3d 的反键效应,但是现代量化计算指出实际上是 P-R σ* 轨道作为 π-acceptor。
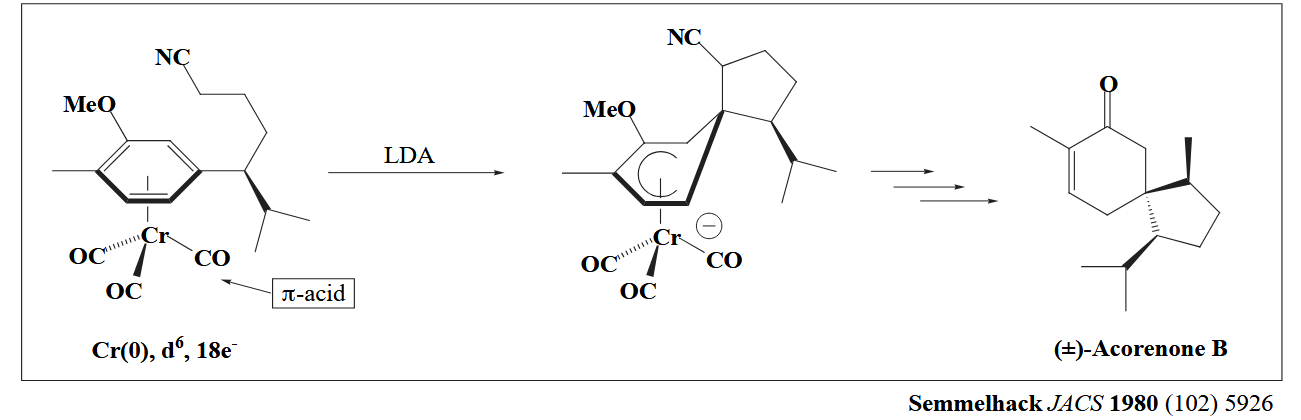
这种 π-backbonding 会对金属连接的配体有所影响,例如下图的例子,CO 作为强 π-acid 配体,从金属 Cr 中拉走了电子,因此让配位的芳基配体更亲电,从而被亲核试剂进攻。
再如下图例子,由于 π-acid 配体的存在,因此金属变得更缺电子,从而更容易发生还原消除降低氧化态。
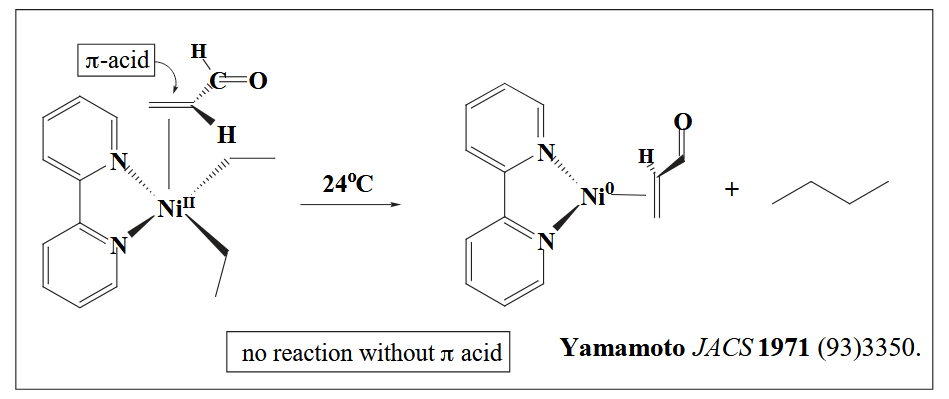
我们上文说到烯烃可以作为 π-acid,同时烯烃也可以作为 σ-donor,因此烯烃金属配合物具有一个双向的 donor-acceptor interaction。选择合适的金属调控 donor-acceptor 作用,可以让烯烃根据需要表现出亲电性或者亲核性。
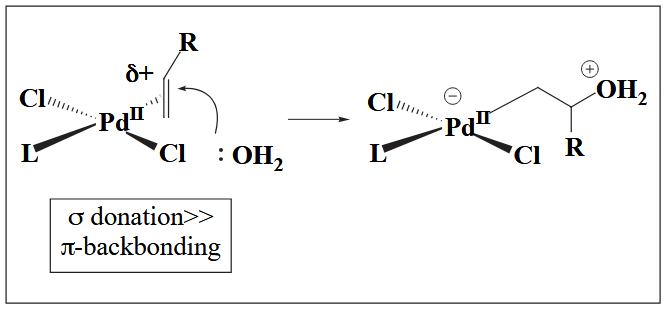
例如 Pd(II) 与烯烃配位时,其 σ-donation >> π-backbonding,因此烯烃表现亲电性,典型例子是 Wacker 氧化。
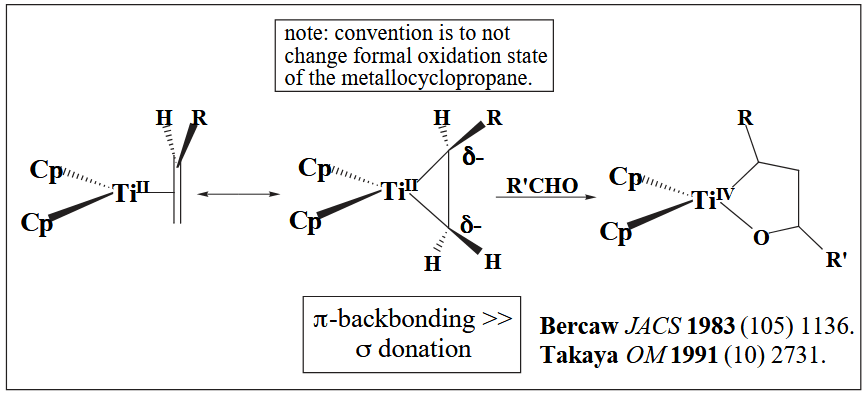
当 Ti(II) 与烯烃配位时,其 π-backbonding >> σ-donation,因此烯烃表现亲核性,烯烃-金属配合物此时以金属环丙烷形式(metallocyclopropane)存在。
最后,这些配体与轨道的效应能够在光谱上表现出来,例如光谱化学序列(spectrochemical series),按照配体对配体场分裂能(ligand-field splitting parameter)的影响大小排列起来,用于衡量配体对场影响的“强度”。
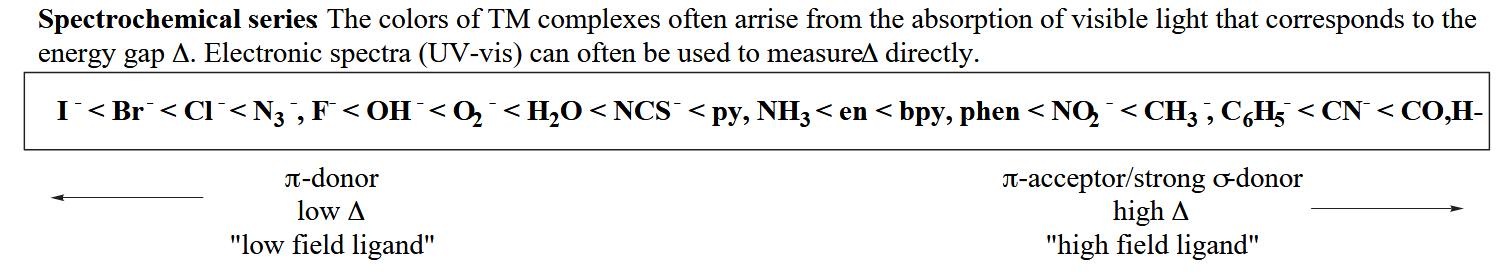
上述讨论的三类配体对配体场的影响可总结如下:强的 σ-donor 会升高 LUMO 能量,因此使配体场分裂能增大;强的 π-donor 会升高 HOMO 能量,因此使配体场分裂能减小;强的 π-acceptor 会降低 HOMO 能量,因此使配体场分裂能增大。
所以强场配体都属于强 σ-donor(如烷基、氢负离子等) 或强 π-acceptor(如 CO、三烷基膦等),反之弱场配体都属于强 π-donor(如卤素离子、烷氧基等)。
1.3 Summary
本章内容基础但很重要,尤其是对于金属所表现出的反应性,从分子轨道和软硬酸碱的角度考虑往往有迹可循。